Terapia hiperbaryczna polega na podawaniu pacjentowi tlenu w środowisku o podwyższonym ciśnieniu. Dzięki zwiększonemu ciśnieniu przyśpieszona jest migracja cząstek tlenu do komórek organizmu co zwiększa ich dotlenienie sprzyjając ich regeneracji i rozwojowi. Podstawowa definicja terapii hiperbarycznej podana jest w „Europejskim Kodeksie Dobrej Praktyki w Terapii Tlenem Hiperbarycznym”. Według tego dokumentu terapia hiperbaryczna jest metodą leczenia chorób i urazów w komorze hiperbarycznej wykorzystującą ciśnienie wyższe niż atmosferyczne.

Na czym polega terapia hiperbaryczna?
Terapia tlenem hiperbarycznym polega na oddychaniu (wentylacji pacjenta) w warunkach zwiększonego ciśnienia niż panujące lokalnie. Umożliwia znaczne zwiększenie rozpuszczalności tlenu we krwi. W warunkach podwyższonego ciśnienia zawartość tlenu w organizmie znacząco wzrasta, między innymi dlatego, że jest nie tylko przenoszony przez hemoglobinę, ale także wzrasta jego rozpuszczalność w osoczu.
Im wyższe ciśnienie oddziałuje na ciało człowieka, tym więcej tlenu rozpuści się w organizmie i tym dalej od kapilarów zawędrują jego cząsteczki. Podobnie, im wyższe stężenie wdychanego tlenu, tym gradient ciśnienia parcjalnego będzie większy i więcej tlenu trafi do tkanek organizmu. Wysokie ciśnienie oraz stężenie tlenu sprawia, że terapia hiperbaryczna (HBOT) szybciej leczy tkanki słabo ukrwione, o niewielkiej perfuzji. Najwolniej regenerują się tkanki, które mają najmniejszy dopływ krwi „białe tkanki”. Ścięgna, więzadła, łąkotki, krążki międzykręgowe, kości, a nawet tkanki mózgowe mają mniejsze sieci kapilarne, a każda z nich wykazuje szybszą naprawę pod wpływem HBOT.
Terapia hiperbaryczna w rehabilitacji kręgosłupa
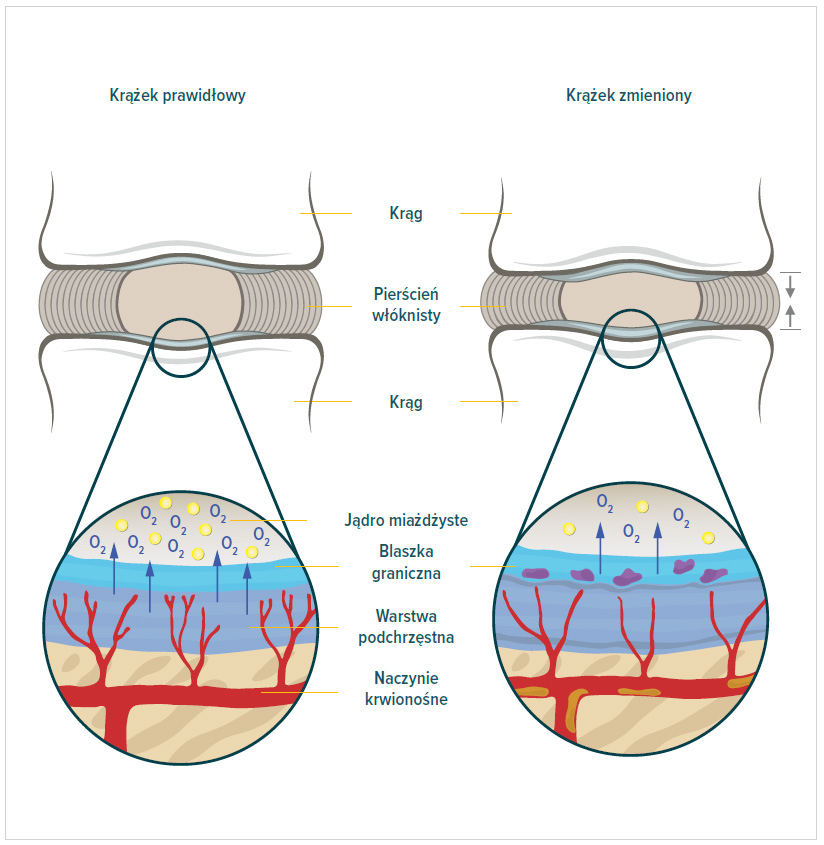
Zasadniczo za proces zwyrodnienia krążka międzykręgowego odpowiadają dwa mechanizmy: zmiany strukturalne oraz zmiany biochemiczne.
Zmiany strukturalne w obrębie krążka międzykręgowego znacząco wpływają na jego mikro strukturę. Prowadzą do zmniejszenia ilości naczyń krwionośnych oraz stężenia tlenu w obrębie dysku, a tym samym ograniczenia dopływu substancji odżywczych i usuwania metabolitów. W niektórych przypadkach dochodzi do zwapnienia blaszki granicznej kręgu, co dodatkowo ogranicza dyfuzję i transport substancji odżywczych.
Uważa się, że mechanizm oparty o zmiany w mikro strukturze stanowi istotny czynnik w postępowaniu zwyrodnienia krążka międzykręgowego będącego skutkiem hipoksji oraz niedoborem substancji odżywczych. Do jego zwyrodnienia przyczyniają się również zmiany na poziomie biochemicznym. Mediatory stanu zapalnego takie jak IL-1, IL-6, NO, PGE 2 oraz metaloproteinazy powodują zwiększoną degradację macierzy pozakomórkowej oraz hamują syntezę proteoglikanów w obrębie jądra miażdżystego doprowadzając do jego dehydratacji1,2,3,5.
Terapia hiperbaryczna wzmaga proces angiogenezy
Terapia hiperbaryczna wzmaga proces angiogenezy i formację nowych naczyń włosowatych. Udowodniono, że ciśnienie parcjalne tlenu w jądrze miażdżystym szybko reaguje na zmiany ciśnienia parcjalnego w naczyniach krwionośnych. Wielokrotnie zwiększone stężenie tlenu w tkankach powoduje aktywację fibroblastów produkujących kolagen oraz proteoglikany wpływające pozytywnie na kondycję dysku. Hamujący wpływ na wydzielanie mediatorów stanu zapalnego oraz zwiększona synteza glikozaminoglikanów pomaga w przywróceniu lokalnej fizjologii krążka międzykręgowego2.
Wpływ terapii hiperbarycznej na krążek międzykręgowy:
- pozytywny wpływ na utrzymanie wysokości krążka międzykręgowego2,
- zwiększenie aktywności fibroblastów1,2,
- pozytywny wpływ na hydratację poprzez promowanie produkcji glikozaminoglikanów2,
- działa przeciwzapalnie na komórki jądra miażdżystego poprzez hamowanie wydzielania mediatorów stanu zapalnego IL-1, PGE-2 i produkcję iNOS w ludzkim jądrze miażdżystym in vitro1,2,3,
- hiperoksygenacja stymuluje wzrost komórek i syntezę macierzy pozakomórkowej oraz hamuje proces apoptozy komórek ludzkiego jądra miażdżystego in vitro - apoptoza jest kluczowym komponentem odpowiedzialnym za spadek ilości komórek jądra miażdżystego podczas jego zwyrodnienia. Zwiększony poziom NO (tlenku azotu) hamuje syntezę proteoglikanów w komórkach ludzkiego krążka międzykręgowego. Odgrywa ważną rolę w patogenezie degeneracji dysku i przyczyniając się do apoptozy komórek1,2,
- HBOT znacząco hamuje wydzielanie IL-1B oraz NO w jądrze miażdżystym. IL-1 - hamuje ekspresję kolagenu typu II oraz agrekanu (ACAN) odpowiedzialnego za prawidłowe uwodnienie jądra miażdżystego3,
- HBOT zwiększa syntezę kolagenu typu II oraz aggrecanu3,
- przeciwdziałanie dalszemu zwyrodnieniu3.
Przebieg terapii hiperbarycznej
Terapia odbywa się w specjalnej komorze hiperbarycznej, która może być jedno- lub wielomiejscowa. Pacjent oddycha czystym tlenem przez maskę lub kaniule, podczas gdy ciśnienie w komorze jest stopniowo zwiększane. Zabieg trwa zwykle od 60 do 90 minut i jest całkowicie bezbolesny. W zależności od wskazań, zaleca się serię kilku lub kilkunastu sesji.
Terapia hiperbaryczna - podsumowanie
Terapia hiperbaryczna to nowoczesna metoda leczenia, która wykorzystuje potencjał tlenu do regeneracji organizmu. Dzięki wszechstronnym korzyściom znajduje zastosowanie w wielu dziedzinach medycyny, od regeneracji po wsparcie w chorobach neurologicznych. Jeśli szukasz skutecznego sposobu na poprawę zdrowia i samopoczucia, terapia hiperbaryczna może być właśnie tym, czego potrzebujesz.
Warto jednak pamiętać, że każda terapia powinna być dostosowana do indywidualnych potrzeb pacjenta i przeprowadzana pod okiem specjalistów. Przed rozpoczęciem zabiegów skonsultuj się z lekarzem, aby upewnić się, że terapia hiperbaryczna jest dla Ciebie bezpieczna i odpowiednia.
Bibliografia:
- Wang et al., Effect of Hyperbaric Oxygenation on Intervertebral Disc Degeneration, 2011. SPINE Volume 36, Number 23, pp 1925–1931.
- Wang et al., Effect of Hyperbaric Oxygenation on Intervertebral Disc Degeneration, 2013. SPINE Volume 38, Number 3, pp E137–E142.
- Chi-Chien Niu et al., Hyperbaric Oxygen Treatment Suppresses MAPK Signaling and Mitochondrial Apoptotic Pathway in Degenerated Human.
- Intervertebral Disc Cells, JOURNAL OF ORTHOPAEDIC RESEARCH FEBRUARY 2013.
- K.A Tomaszewski et al., Biology of the human intervertebraldisc and its endplates, Folia Morphol., 2015, Vol. 74, No.2



